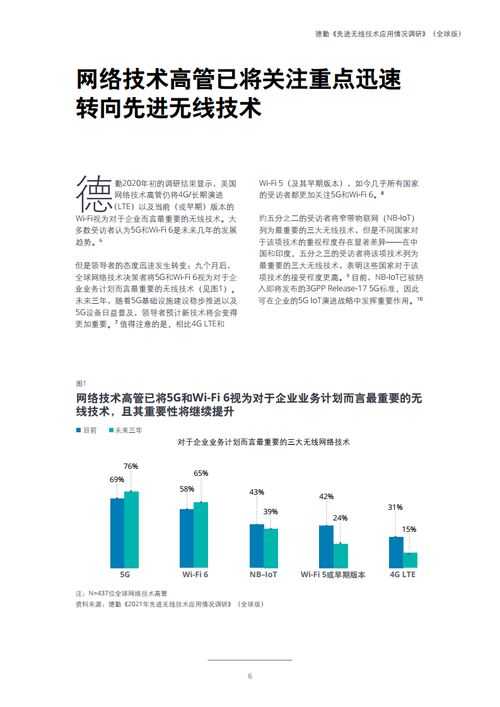
免于臨床試驗的二三類醫(yī)療器械目錄征求意見稿技術(shù)咨詢解析

為優(yōu)化醫(yī)療器械監(jiān)管流程、加快產(chǎn)品上市進(jìn)程,國家藥品監(jiān)督管理局發(fā)布了《免于臨床試驗的第二類、第三類醫(yī)療器械目錄(征求意見稿)》。該目錄的制定旨在基于科學(xué)評估和風(fēng)險管理原則,對部分成熟、低風(fēng)險的二三類醫(yī)療器械豁免臨床試驗要求,以減輕企業(yè)負(fù)擔(dān),同時保障公眾健康。本文就目錄的相關(guān)技術(shù)咨詢內(nèi)容進(jìn)行解析,幫助企業(yè)更好地理解和應(yīng)對政策變化。
目錄的制定依據(jù)主要包括醫(yī)療器械的臨床使用歷史、技術(shù)成熟度、風(fēng)險等級以及國內(nèi)外監(jiān)管經(jīng)驗。例如,部分已在國內(nèi)或國際廣泛使用、且風(fēng)險可控的器械,如某些影像診斷設(shè)備、康復(fù)輔助器具等,可能被納入豁免范圍。企業(yè)應(yīng)關(guān)注目錄的具體產(chǎn)品清單,結(jié)合自身產(chǎn)品特性判斷是否符合豁免條件。
企業(yè)在申請豁免時需準(zhǔn)備充分的技術(shù)資料,包括產(chǎn)品描述、性能驗證數(shù)據(jù)、生物相容性評估、以及風(fēng)險分析報告等。這些材料應(yīng)能證明產(chǎn)品與已上市同類產(chǎn)品具有等同性,或風(fēng)險水平較低,無需通過臨床試驗即可確認(rèn)其安全有效性。建議企業(yè)提前與監(jiān)管部門或?qū)I(yè)機構(gòu)進(jìn)行技術(shù)咨詢,確保資料完整性和合規(guī)性。
征求意見稿的發(fā)布為行業(yè)提供了反饋機會。企業(yè)可通過官方渠道提交意見和建議,例如針對特定產(chǎn)品的納入標(biāo)準(zhǔn)或豁免流程提出修改。參與此類咨詢不僅有助于完善政策,還能幫助企業(yè)把握監(jiān)管趨勢。
盡管豁免臨床試驗可縮短產(chǎn)品上市時間,但企業(yè)仍需強化主體責(zé)任,持續(xù)監(jiān)控產(chǎn)品上市后性能,并建立有效的質(zhì)量管理體系。監(jiān)管部門也將加強事后監(jiān)督,確保醫(yī)療器械的安全使用。
免于臨床試驗?zāi)夸浀耐瞥鍪轻t(yī)療器械監(jiān)管改革的重要一步。企業(yè)應(yīng)積極跟進(jìn)政策動態(tài),善用技術(shù)咨詢資源,以實現(xiàn)高效合規(guī)的產(chǎn)品上市。
如若轉(zhuǎn)載,請注明出處:http://www.falcont91.cn/product/32.html
更新時間:2026-01-25 06:13:29